コンセプトの証明
コンセプトの証明
白金メッキされたニッケル被覆ステンレス鋼カソードは、概念実証実験で水素を生成しましたが、Ni 0.9Co0.1(OH)2アノードは酸化されました 5 M KOH水溶液(pH 15)でNi0.9Co0.1OOHに変換します。 使用したアノードは、再生容量が5 Ccm-2のNi0.9Co0.1(OH)2アノードでした。 で 電流密度が50mAcm-2の場合、水素生成段階は周囲温度で100秒間実行されました(加熱または冷却なし)。 我々 印加されるセル電圧を、熱中性電圧(1.48 V)より120mV以下高く設定します。
これにより、熱損失が減少し、酸素の形成とアノードの過充電が防止されました。これにより、NiOOHが-相から-p相に遷移した可能性があります。 この電荷量の場合、アノード帯電反応のファラデー効率は、溶存酸素の測定値に基づいて99.2%でした。 間に 水素生成(充電)プロセス、セル電圧Vcell、およびアノード電位Eanodeが記録され、図3aに示されています。
帯電したアノードをコールドセルから取り出し、高温(T = 95°C)の電解質(5 M KOH)に100秒間入れました。 自発的な酸素放出とその開始条件の再生を促進する水素生成段階。 アノード再生プロセス中、 有意な気泡(O2)の形成が検出されましたが、気泡(H2)は、水素生成ステップ中にのみカソード上に生成されました。
充電段階のそれぞれの間、セル電圧とアノード電位は一貫して増加し、サイクルごとの変動はほとんどなく、連続的ではありませんでした ドリフト(図3a)。 アノードのSOCは初期状態に戻り、各サイクルの終わりに定量化可能な変化はありません。これは、プロセスが サイクリング可能で、劣化しません。 Ex-situ微細構造(SEM)および結晶化度(X線粉末回折)の調査は、 そしてこれを実証するためにDual-TCEサイクルの後。 水素生成段階では、アノード電位は1.37– 1.45 V RHEの範囲でした(図。 3a)、これは、Ni0.9Co0.1(OH)2およびNiFeLDHアノードの両方のOER電位を大幅に下回っています。
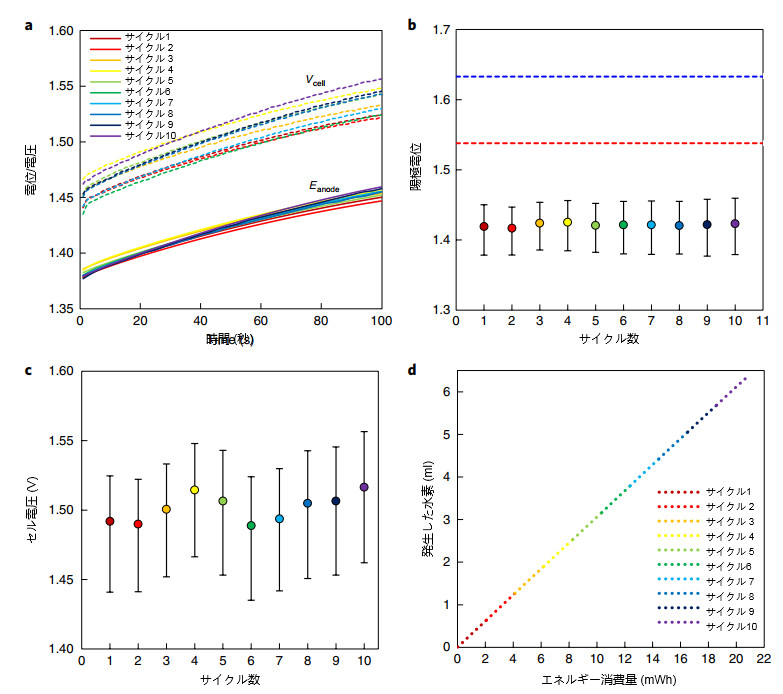
酸素発生はこれらの電位で制限されます。 全体として、セル電圧は1.44〜1.56 Vの範囲であり(図3a)、10個すべてで平均1.5Vでした。 サイクル(図3c)。 10サイクルすべてについて、Dual-TCEプロセスの電圧効率。ここで、Vthは水分解の熱中性電圧です。 反応(通常の条件下で1.48 V)、平均98.7%。 図3d、6.4に示すように、サイクル中に測定された電流とセル電圧に基づく 図3に示す10サイクルの間に、20.8 mWhを必要とするml水素(1気圧および25℃)が生成されました。
最初に、同様の測定が10〜200mAcm-2の範囲の想定電流密度で実行されました。 10 mA cm-2で、平均セル電圧 1.44 Vに増加し、200 mAcm-2では1.60Vに増加しました。これらの測定では、アノード電位はNiFeLDHの電位よりも低かった。 ベンチマークアノード。これは、当社のDual-TCE技術が、最先端の水を使用したアルカリ電解よりも電気化学的効率が高いことを示しています。 酸化触媒。 次に、図3に示すように、同じ公称電流密度(50 mA cm-2)で100サイクルが実行され、安定していることを示しています。 アルカリ性溶液での長期操作。

図4| マルチセルDual-TCEプロセスの概略図。
a, プロセス中の一般的な電解質の流れ。セルA内を循環し、H2ガスを生成する冷たい電解質を示しています。 つまり、左側の中央(青色)のタンクで相分離され、高温の電解質がセルBを循環して、O2ガスを生成します。 左側の赤いタンクで相分離。 左側の灰色のタンクの中温洗浄液はバイパスを循環します ほとんどの時間。 この液体は、‘プッシュ’に使用されます。 H2の終わりにあるそれぞれのタンクへの低温および高温電解液 生成またはO2生成ステップ。 b, H2が生成される各セルの再生動作を示す単一セルサイクル 周囲温度で電気バイアス下にあり、電気バイアスをかけずに高温でO2が発生します(開回路)。 * R、 残留ガス。
炭酸塩緩衝液でのデュアルTCE水分解
これまでのところ、概念実証実験は濃アルカリ溶液で行われてきましたが、これは一部のアプリケーションには適さない可能性があります。 非常に苛性の状態は許容されません。極端なpH値での操作に関連するシステムコストのバランスが低いため、 低純度の水源を使用する可能性があるため、溶液のpHを危険性の低いレベルに下げるオプションは、低コストの実装に有利です。 pHが10.6の炭酸塩と重炭酸塩(K2CO3:KHCO3の比率が3:2)の緩衝電解液で作業することにより、 技術。 25 mA cm-2の公称電流密度で、このテストではアノード電位は1.43– 1.50VRHEの範囲でした。これは、 デュアルTCE水分解法は、アルカリ性溶液に限定されず、より広い範囲の電気化学で使用される可能性があります。 アプリケーション。
スケールアップと展開に向けたイニシアチブ
概念実証実験の結果(図3)と追加のテストは、Dual-TCE水分解プロセスが 安全な動作を確保しながら、幅広い電流密度でさまざまな動作条件下で高い電気化学的効率を実現します H2/O2クロスオーバーなし。 図4aに示すように、マルチセルシステムを想定して、このプロセスを運用可能なプロトタイプシステムに変換します。 純粋な水素および酸素ガスの流れ。
以前の概念実証テストとは異なり、このシステムは、各セルに固定アノードとカソードを備えたスイング設計を使用しています。 低温 電解質は水素製造中にセルAを通過し、水素気泡を水素分離器に輸送します。
高温の電解質が同時にセルBを通過して、(すでに充電された)アノードを再生し、酸素を生成して、酸素の泡を 酸素分離器。システム全体は、可動電極がなく、高温および低温の可動電解質溶液のみで構成されています。の混合を避けるために 中間温度であるサイクルステップ間の切り替え中に、水素飽和(酸素飽和)電解質と高温(低温)電解質 流体を利用して、各セル内の冷たい(熱い)電解質を適切な分離タンクに移します。すべてのセルが進むサイクル スルーは図4bに示されています。これは、中間置換流体がコールドステップとホットステップの間でセルを満たしていることを示しています。さらに、 図1bに示されているように、電極は、図4bに示されているように、水素製造段階でのみ再生可能電源に接続されます。
システムは密閉され、高純度の水素と酸素の流れを作り出すことができます。 さらに、ガス混合のリスクを下げることにより、 提案された概念は、各セルでの水素と酸素の合成を一時的に分離することでより安全になります。 最後に、図4aに示すように、 システムは多数のセルで構成されるように設計されており、一部のセルは水素を生成し、他のセルはいつでも酸素を生成します。 の調査結果 図3に示されているエネルギーと熱のバランスは、実行されるDual-TCEサイクルの最初の段階での電気エネルギー消費のみを反映しています。 加熱せずに周囲温度で。
アノードは、アノード再生反応を加速するために、第2段階で95℃に加熱される。 これにより、プロセス全体で熱損失が発生します エネルギーバランス。 ただし、Dual-TCEプロセスの最初のステップはVcell1.56 Vの吸熱反応であり、2番目のステップは発熱反応であるため、熱損失が発生します。 コールドステップとホットステップの間のスイングによって引き起こされる原因は、ホットコンポーネントの注意深い熱管理と断熱、および O2生成中に放出される熱が他のわずかな熱損失を補うように、アノードの容量を増やします。 この熱損失は 2 kWhkg-1H2以下を追加します。
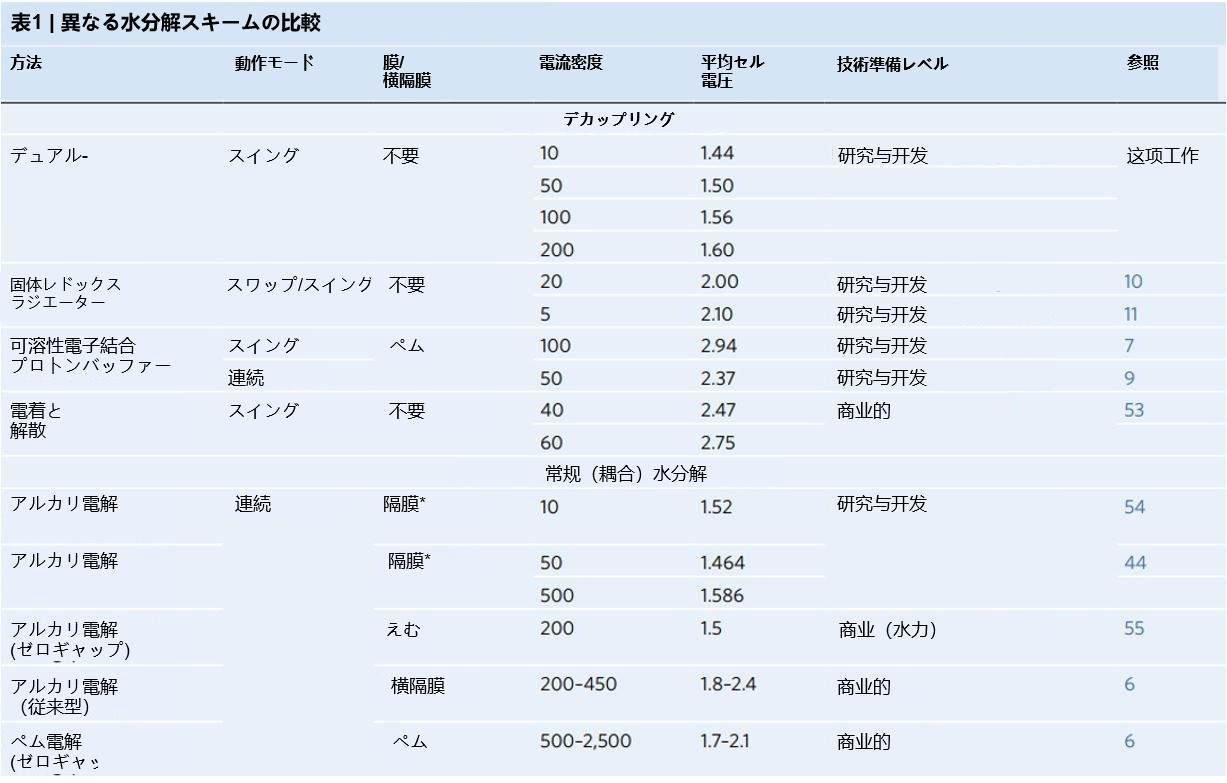
報告されたテストではダイヤフラムは使用されていません。 AEM、陰イオン交換膜; WOC、水の酸化触媒。 動作パラメータと 電気化学的効率(平均セル電圧)は、分離された水分解、チャンピオンによるアルカリ電気分解に関する画期的なレポートとして示されています 触媒、市販のアルカリ電解槽およびPEM電解槽
デュアルTCEアプローチの利点
メンブレンフリーセルでは、Dual-TCE技術が水を分離し、時間的に独立したステップで水素と酸素を生成します。 メンブラネルの電気分解 この結果として、従来の水の電気分解に比べて多くの一般的な利点があります。 材料費と組立費が低いのは、デバイスの削減によるものです 複雑; 電解質中の不純物に対する高い耐性と、通常は膜を汚す悪条件。 と操作する能力 低コストの触媒および/または建設資材の使用を可能にしながら、操作上の安全性を向上させる無害な緩衝液で。
プロトン交換膜(PEM)/アルカリ電解では、膜/セパレーターを横切るH2 / O2クロスオーバーの問題は、私たちの技術で克服されます。 部分負荷水分解と高圧水素製造への道を開く。 Dual-TCE技術は、その優れた技術でも知られています 効率。 アノード電位を、最もよく報告されている水酸化触媒と競合するレベルまで下げることができました。 水酸化ニッケルの単一電子酸化イベントを伴う4電子OERと、水の酸化を別々の1電子電気化学および 熱的に活性化された化学的ステップ。 Dual-TCEプロセスは、Niを使用した以前の研究よりもはるかに効率が高いことも注目に値します。 水の酸化および還元反応を分離するための補助電極としての(OH)2/NiOOHレドックスペア。
これは、私たちの技術では、電極を必要とせずに、Ni(OH)2 / NiOOHを水と反応させることにより、修飾されたアノードで酸素が自然に生成されるためです。 外部電源からの分極。 以前は、酸素は従来のアノードで電気化学的に生成されましたが、 以前の調査結果によると、Ni(OH)2/NiOOH補助電極が放電しました。 NiOOHサイトへの水の浸透は、当社のアノード設計によって可能になり、 コバルトの添加は、電子とプロトンの伝導性を高め、Ni + 2 / Ni + 3の酸化還元電位を陰極的に変化させ、この化学物質が 場所。 以前の論文では、電気化学反応と化学反応を組み合わせた方法について説明しました。 それは機能する分子レドックスメディエーターを採用しています Ni(OH)2/NiOOHアノードと同様です。
固体レドックスメディエーター(Ni(OH)2 / NiOOHアノード)を使用すると、荷電種の移動を防ぐことにより、膜の必要性がなくなります。 アノードとカソードの間。さらに、可溶性レドックスメディエーターは酸性環境で作用するため、希土類触媒の使用が必要になります プラチナのように。一方、当社の固体レドックスメディエーターはアルカリ性溶液で機能し、低コストで地球に豊富な雇用を可能にします 触媒。最後に、私たちの方法は、プロトン還元よりも過電圧が高い従来の水の酸化反応に取って代わり、結果として 以前に報告されたよりも高い効率。表1は、Dual-TCEプロセスの電気化学的効率(セル電圧)を以前のプロセスと比較しています。 分離された水分解、およびチャンピオン触媒、市販のアルカリ電解槽、およびPEMを使用したアルカリ電解に関する独創的な研究 電解槽。
現在、当社のアノードの公称電流密度は最大200 mA cm-2であり、これは市販のアルカリ水電解槽の性能の下限です。 より高い 電流密度は、アノード製造プロセスのさらなる改良と高表面積基板の使用を必要とします。 それは注目に値します デュアルTCEプロセスは全体で行われるため、アノードと電解アノードを間接的に比較することは困難です。 活性Ni0.9Co0.1(OH)2層の体積に対して、電気分解は水の酸化触媒の表面のみを含みます。 同一のものを使用する 基板と測定条件、ベンチマーク水酸化触媒(NiFe LDH)との直接比較により、アノードの動作が明らかになります 電位は水酸化触媒の電位よりも低い(図3b)。
結論
世界中で断続的な再生可能エネルギーの使用が増えるにつれ、余剰エネルギーを貯蔵する効果的で実行可能な方法はさらに増えるでしょう。 重要。私たちのDual-TCE技術は、再生可能エネルギーシステムと組み合わせると、ほぼ熱中性の下で水が分裂することを示しています 状況が考えられます。このプロセスを改善するために検討できるいくつかのオプションを強調します。最適なアノード材料を設計することで、 ここにコバルトを含めることで示されるように、電気化学的特性と拡散速度を向上させます。これらのアノードは、耐えるように変更できます 高圧、加圧水素製造を可能にします。燃料電池システムと組み合わせると、これは電気自動車のアプリケーションにつながります 輸送用給油所、化学合成、およびエネルギー貯蔵。さらに、私たちの方法が炭酸塩含有に耐えられることを示します 中程度のpHレベルの電解質。これは強力なKOH溶液よりもはるかに危険性が低くなります。さらに、同等のメンブレンフリーセルでは、CO2 還元はアノード酸化と組み合わせることができ、地理的および時間的にCO2を分離することにより、製品の分離が改善されるという追加の利点があります。 酸素発生による減少。このようなアプローチは、より少ないエネルギーを使用する電解化学製品の生産への道を開きます。
